در حال حاضر تجهیزات پزشکی به طور گستردهای برای تشخیص و درمان بیماران استفاده میشوند و از این جهت خطاهای استفاده که ناشی از ناکافی بودن قابلیت استفاده تجهیزات پزشکی هستند، به یک موضوع نگرانکننده تبدیل شدهاند. قابلیت استفاده به ویژگیهای رابط کاربری یک دستگاه گفته میشود که به تسهیل استفاده از آن کمک میکند و موجب میشود کاربر بتواند وظایف مورد نظر را بهدرستی و با کارایی مطلوب انجام دهد و از نتیجه عملکرد خود رضایت داشته باشد. با پیشرفتهای صورت گرفته در حوزه سلامت و پزشکی، کاربران کمتر ماهر، از جمله خود بیماران، اکنون از تجهیزات پزشکی استفاده میکنند و امکان بروز خطا افزایش پیدا کرده است. بسیاری از تجهیزات پزشکی که بدون اعمال فرآیند مهندسی قابلیت استفاده توسعه یافتهاند، غیر شهودی، دشوار برای یادگیری و دشوار برای استفاده هستند. طراحی رابط کاربری برای دستیابی به قابلیت استفاده کافی نیازمند فرآیند و مهارتهای متفاوتی نسبت به پیادهسازی فنی رابط کاربری است.
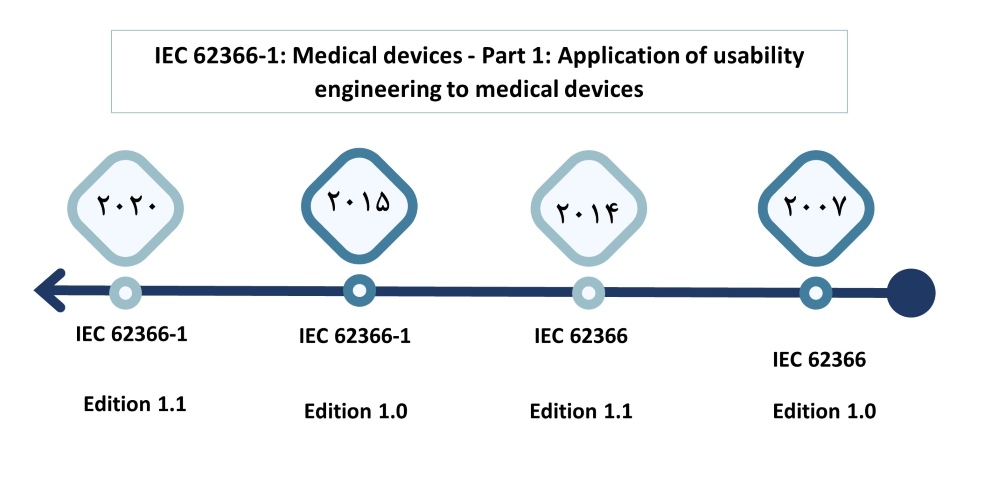
استانداردهای بینالمللی مرتبط با قابلیت استفاده تجهیزات پزشکی، فرآیندی را جهت بهبود قابلیت استفاده این تجهیزات معرفی میکنند. این فرآیند مهندسی قابلیت استفاده امکان شناسایی و ارزیابی خطاهای استفاده و کاهش آنها را فراهم میکند. در ادامه به معرفی این استانداردها میپردازیم. نسخههای اول و دوم استاندارد IEC60601-1-6، فرآیند مهندسی قابلیت استفاده را توضیح دادند که متناسب با نیازهای تولیدکنندگان تجهیزات پزشکی الکتریکی بود. آنها راهکارهایی در مورد نحوه پیادهسازی و اجرای این فرآیند برای بهبود ایمنی تجهیزات پزشکی الکتریکی ارائه دادند تا تولیدکننده بتواند قابلیت استفاده را تجزیه و تحلیل، مشخص، طراحی، تأیید و اعتبارسنجی کند، زیرا مربوط به ایمنی اولیه و عملکرد ضروری تجهیزات پزشکی الکتریکی است. پس از آنکه نسخه دوم این استاندارد منتشر شد، سازمان IEC با همکاری سازمان ISO، یک استاندارد مهندسی قابلیت استفاده عمومی را تحت عنوان IEC 62366:2007 تدوین و در سال 2007 منتشر کرد که برای همه دستگاههای پزشکی (نه فقط تجهیزات پزشکی الکتریکی) قابل اعمال است. استاندارد IEC 62366 بر اساس IEC 60601-1-6 پایهریزی شده، اما با استفاده از تجربیاتی که از بهکارگیری IEC 60601-1-6 کسب شده بود، بهبود یافته است. در سال 2008، IEC پروژهای برای بازبینی IEC 60601-1-6 تصویب کرد تا مطالب تکراری با IEC 62366 کاهش یافته یا حذف شود و همچنین پلی بین IEC 60601-1 و IEC 62366 ایجاد گردد. این نسخه سوم IEC 60601-1-6 که در سال 2010 منتشر شد آن پل را ایجاد کرد و به تولیدکننده امکان داد تا با بهکارگیری فرآیند مهندسی قابلیت استفاده مطابق با IEC 62366:2007، با الزامات IEC 60601-1:2005 که بهصورت الزامی به IEC 60601-1-6 ارجاع دادهاند، مطابقت داشته باشد. در سال 2015 نسخه اول استاندارد IEC 62366-1:2015، نسخه اول استاندارد IEC 62366 که در سال 2007 منتشر شده بود را لغو کرد و جایگزین آن شد تا مفاهیم معاصر مهندسی قابلیت استفاده را نیز در بر بگیرد، فرآیند را سادهتر کند و ارتباط با روشهای مرتبط با مدیریت ریسک را که در جنبههای ایمنی رابطهای کاربری دستگاههای پزشکی اثرگذارند، تقویت کند.

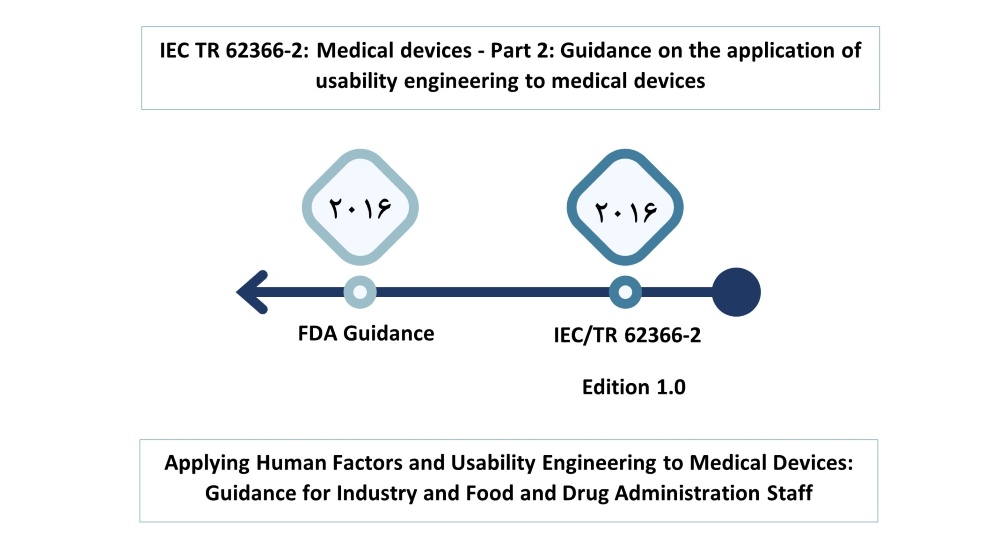
در سال 2016 سازمان IEC با سازمان ISO، گزارش فنی IEC TR 62366-2: Medical devices – Part 2: Guidance on the application of usability engineering to medical devices را منتشر کردند که شامل اطلاعات آموزشی و راهنمایها برای کمک به تولیدکنندگان در رعایت استاندارد IEC 62366-1:2015 است و همچنین توضیحات مفصلتر از روشهای مهندسی قابلیت استفاده را ارائه میدهد که میتوانند به طور کلیتر در تجهیزات پزشکی، فراتر از جنبههای ایمنی رابطهای کاربری تجهیزات پزشکی، اعمال شوند. این گزارش فنی حاوی هیچ الزامی نیست و فقط راهنمایی و اطلاعات آموزشی ارائه میدهد.
سازمان غذا و دارو آمریکا (FDA) نیز در سال 2016، راهنمایی را در حوزه مهندسی قابلیت استفاده تجهیزات پزشکی تحت عنوان Applying Human Factors and Usability Engineering to Medical Devices: Guidance for Industry and Food and Drug Administration Staff منتشر کرد تا به صنعت تجهیزات پزشکی در پیروی از فرآیندهای مناسب مهندسی قابلیت استفاده کمک کند و احتمال ایمن و مؤثر بودن دستگاههای پزشکی جدید برای کاربران، مصارف و محیطهای مورد نظر را به حداکثر برساند. توصیههای موجود در این سند راهنما با هدف حمایت از تولیدکنندگان در بهبود طراحی دستگاهها برای کاهش خطاهای احتمالی استفاده و آسیبهای ناشی از آن ارائه شدهاند. FDA معتقد است که این توصیهها به تولیدکنندگان امکان ارزیابی و کاهش ریسکهای مرتبط به استفاده از دستگاههای پزشکی را میدهد.
مهندسی قابلیت استفاده بهکارگیری دانش درباره رفتار انسان، تواناییها، محدودیتها و سایر ویژگیها در طراحی وسیله پزشکی برای رسیدن به قابلیت استفاده مناسب است. برای دستیابی به این هدف، فرآیند مهندسی قابلیت استفاده بهصورت مرحلهبهمرحله انجام میشود تا اطمینان حاصل شود که طراحی نهایی وسیله پزشکی پاسخگوی نیازها و تواناییهای کاربران است و استفادهای ایمن را فراهم میکند. در ادامه به بررسی مراحل مختلف فرآیند مهندسی قابلیت استفاده مطابق با استاندارد IEC 62366-1 میپردازیم.
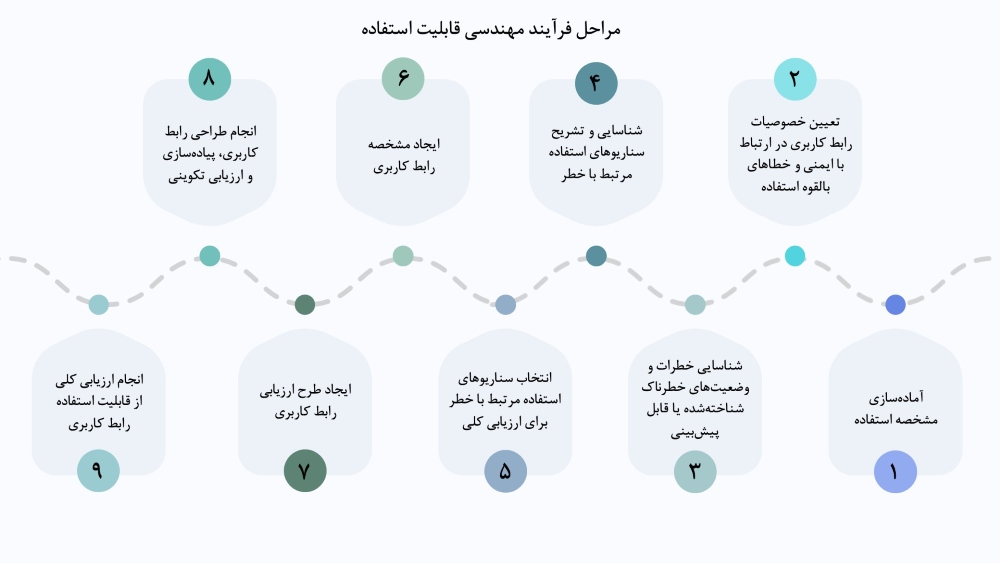
مرحله اول: آﻣﺎدهﺳﺎزى ﻣﺸﺨﺼﻪ اﺳﺘﻔﺎده
در اولین مرحله از فرآیند مهندسی قابلیت استفاده محصول پزشکی، ﻳﻚ ﻣﺸﺨﺼﻪ اﺳﺘﻔﺎده برای آن آماده میشود که شامل موارد زیر است:
- کاربرد ﭘﺰﺷﻜﻲ ﻣﻮردﻧﻈﺮ
- ﺟﻤﻌﻴﺖ ﺑﻴﻤﺎر ﻣﻮردﻧﻈﺮ
- مشخصات ﻛﺎرﺑﺮ ﻣﻮردﻧﻈﺮ
- ﺑﺨﺸﻲ از ﺑﺪن ﻳﺎ ﻧﻮع ﺑﺎﻓﺖ ﻣﻮردﻧﻈﺮ ﺑﻜﺎر رﻓﺘﻪ ﻳﺎ در ﺗﻌﺎﻣﻞ
- ﻣﺤﻴﻂ اﺳﺘﻔﺎده
- اﺻﻮل ﻋﻤﻠﻜﺮد
مرحله دوم: ﺗﻌﻴﻴﻦ ﺧﺼﻮﺻﻴﺎت رابط ﻛﺎرﺑﺮی در ارﺗﺒﺎط ﺑﺎ اﻳﻤﻨﻲ و ﺧﻄﺎﻫﺎى ﺑﺎﻟﻘﻮه اﺳﺘﻔﺎده
در این مرحله، مشخص میشود کدام ویژگیهای رابط کاربری (مثل دکمهها، نمایشگرها، هشدارها و …) میتوانند بر ایمنی کاربر یا بیمار تأثیر بگذارند. برای این کار، لازم است از تحلیل ریسک (بر اساس استاندارد ISO 14971) کمک گرفته شود تا مشخص شود کدام قسمتهای رابط کاربری ممکن است باعث بروز خطاهای استفاده شوند. در مرحله بعد ﺑﺮ اﺳﺎس این ویژگیهای رابط ﻛﺎرﺑﺮى و ﻣﺸﺨﺼﻪ اﺳﺘﻔﺎده، ﺧﻄﺎﻫـﺎى اﺳـﺘﻔﺎده ﻛـﻪ ﻣﻲﺗﻮاﻧﺪ رخ دﻫﺪ و ﺑﻪ رابط ﻛﺎرﺑﺮی ﻣﺮﺗﺒﻂ اﺳﺖ ﺷﻨﺎﺳﺎﻳﻲ میشود.
مرحله سوم: ﺷﻨﺎﺳﺎﻳﻲ ﺧﻄﺮات و وﺿﻌﻴﺖﻫﺎى ﺧﻄﺮﻧﺎك ﺷﻨﺎﺧﺘﻪﺷﺪه ﻳﺎ ﻗﺎﺑﻞ ﭘﻴﺶﺑﻴﻨﻲ
در این مرحله به عنوان بخشی از تحلیل ریسک (بر اساس استاندارد ISO 14971)، ﺧﻄﺮات و وﺿﻌﻴﺖﻫﺎى ﺧﻄﺮﻧﺎك ﺷﻨﺎﺧﺘﻪﺷﺪه ﻳـﺎ ﻗﺎﺑـﻞ ﭘـﻴﺶﺑﻴﻨـﻲ ﺷﻨﺎﺳـﺎﻳﻲ میشوند ﻛـﻪ ﻣﻲﺗﻮاﻧﻨﺪ ﺑﺮ روى ﺑﻴﻤﺎران، ﻛﺎرﺑﺮان ﻳﺎ ﺳﺎﻳﺮﻳﻦ در ارﺗﺒﺎط ﺑﺎ اﺳﺘﻔﺎده از وسیله ﭘﺰﺷﻜﻲ ﺗﺄﺛﻴﺮ ﺑﮕﺬارد.
در ﺣﻴﻦ ﺷﻨﺎﺳﺎﻳﻲ ﺧﻄﺮات و وﺿﻌﻴﺖﻫﺎى ﺧﻄﺮﻧﺎك ﻣﻮارد زﻳﺮ ﺑﺎﻳﺪ در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﻮد:
- ﻣﺸﺨصه استفاده تعیین شده در مرحله اول
- ﺧﻄﺎﻫﺎى اﺳﺘﻔﺎده ﺷﻨﺎﺳﺎﻳﻲﺷﺪه در مرحله دوم
- اﻃﻼﻋﺎت در ﻣﻮرد ﺧﻄﺮات و وﺿﻌﻴﺖﻫﺎى ﺧﻄﺮﻧﺎك ﺷﻨﺎﺧﺘﻪﺷﺪه از رابطهای ﻛﺎرﺑﺮى ﻣﻮﺟﻮد وسایل ﭘﺰﺷـﻜﻲ از ﻳﻚ ﻧﻮع ﻣﺸﺎﺑﻪ
مرحله چهارم: ﺷﻨﺎﺳﺎﻳﻲ و ﺗﺸﺮﻳﺢ ﺳﻨﺎرﻳﻮﻫﺎى استفاده ﻣﺮﺗﺒﻂ ﺑﺎ خطر
در این مرحله، سناریوهای استفادهای که میتوانند منجر به خطر شوند شناسایی و بهصورت منطقی توضیح داده میشوند. این سناریوها در واقع داستانهایی واقعی از نحوهی تعامل کاربر با دستگاه هستند که در آنها احتمال بروز خطا یا حادثه وجود دارد. ﺗﻮﺿـﻴﺢ ﻫـﺮ ﺳـﻨﺎرﻳﻮى استفاده ﻣـﺮﺗﺒﻂ ﺑـﺎ خطر ﺷﻨﺎﺳﺎﻳﻲﺷﺪه ﺷﺎﻣﻞ ﻛﻠﻴﻪ وﻇﺎﻳﻒ و ﺗﻮاﻟﻲ آنﻫﺎ و ﻫﻤﭽﻨﻴﻦ ﺷﺪت ﺻﺪﻣﻪ ﻣﺮﺗﺒﻂ ﺑﺎ آسیب است.
مرحله پنجم: اﻧﺘﺨﺎب ﺳﻨﺎرﻳﻮﻫﺎى استفاده ﻣﺮﺗﺒﻂ ﺑﺎ خطر ﺑﺮاى ارزﻳﺎﺑﻲ ﻛﻠﻲ
در این مرحله، از بین سناریوهای خطر شناساییشده، آنهایی که باید در ارزیابی کلی مورد بررسی قرار گیرند، انتخاب میشوند. این انتخاب کمک میکند تا تمرکز فرآیند ارزیابی کلی روی سناریوهایی باشد که بیشترین تأثیر را بر ایمنی کاربران و بیماران دارند. یکی از روشهای زیر برای انتخاب سناریوها استفاده میشود:
- ﻛﻠﻴﻪ ﺳﻨﺎرﻳﻮﻫﺎى استفاده ﻣﺮﺗﺒﻂ ﺑﺎ خطر (در صورتی که تعداد آنها کم است)
- انتخاب بخشی از سناریوها بر اساس شدت آسیب بالقوه؛ یعنی تمرکز بر مواردی باشد که میتوانند بیشترین آسیب را ایجاد کنند.
- انتخاب بخشی از سناریوها بر اساس شدت آسیب و شرایط خاص دستگاه یا تولیدکننده؛ مثلاً برای وسایل پزشکی خاص یا شرایط محیطی ویژه
مرحله ششم: اﻳﺠﺎد ﻣﺸﺨﺼﻪ رابط ﻛﺎرﺑﺮی
در این مرحله، یک مشخصه رابط کاربری تهیه و نگهداری میشود. مشخصه رابط کاربری بر اساس نتایج مراحل قبلی (مشخصه استفاده، ﺧﻄﺎﻫﺎى اﺳﺘﻔﺎده ﺷﻨﺎﺧﺘﻪﺷﺪه ﻳﺎ ﻗﺎﺑﻞ ﭘﻴﺶﺑﻴﻨﻲ ﻣﺮﺗﺒﻂ ﺑﺎ تجهیز ﭘﺰﺷﻜﻲ و ﺳﻨﺎرﻳﻮﻫﺎى استفاده ﻣﺮﺗﺒﻂ ﺑﺎ خطر) شکل میگیرد و موارد زیر را شامل میشود:
- الزامات فنی قابل آزمون برای بخشهای مختلف رابط کاربری
- ﻣﺸﺨﺺ ﻛﺮدن اﻳﻨﻜﻪ آﻳﺎ مدارک ﻫﻤﺮاه (مثل دستورالعمل استفاده) ﻣﻮرد ﻧﻴﺎز اﺳﺖ ﻳﺎ ﺧﻴﺮ
- ﻣﺸﺨﺺ ﻛﺮدن اﻳﻨﻜﻪ آﻳﺎ آﻣﻮزش ﺧﺎص وسیله ﭘﺰﺷﻜﻲ ﻣﻮردﻧﻴﺎز اﺳﺖ ﻳﺎ ﺧﻴﺮ
مرحله هفتم: اﻳﺠﺎد ﻃﺮح ارزﻳﺎﺑﻲ رابط ﻛﺎرﺑﺮی
در این مرحله، یک طرح مشخص برای ارزیابی رابط کاربری تهیه میشود. هدف از این طرح، مشخص کردن روشها، زمانبندی، محیط و شرایطی است که قرار است طراحی رابط کاربر از نظر ایمنی، کارایی و سهولت استفاده مورد بررسی قرار بگیرد. این طرح باید شامل دو نوع ارزیابی باشد:
طرح ارزیابی تکوینی:
این نوع ارزیابی در مراحل طراحی و توسعه انجام میشود تا مشکلات و خطاهای احتمالی در مراحل اولیه شناسایی شوند. در طرح ارزیابی تکوینی باید مشخص شود:
- از چه روشهایی برای ارزیابی استفاده میشود (مثل مشاهده، مصاحبه یا آزمون کاربر).
- کدام بخش از رابط کاربری در حال بررسی است (مثل صفحه نمایش، کنترلها، پیامهای هشدار).
- در چه زمانی از فرآیند توسعه، هر ارزیابی انجام میشود.
طرح ارزیابی کلی:
این ارزیابی در پایان فرآیند طراحی و توسعه انجام میشود تا تأیید شود که رابط کاربر نهایی ایمن و قابل استفاده است. در طرح ارزیابی کلی باید موارد زیر مشخص شود:
- روش انجام ارزیابی و دلیل انتخاب آن
- بخشهای رابط کاربری که در ارزیابی مورد بررسی قرار میگیرند.
- معیارهایی برای اطمینان از اینکه اطلاعات ایمنی، بهدرستی دیده و درک میشوند و از بروز خطا جلوگیری میکنند.
- تعیین اینکه آیا آموزش خاص یا مدارک همراه در طول ارزیابی ارائه میشوند یا خیر.
- در آزمونهای قابلیت استفاده، باید:
- ترکیب و ویژگیهای شرکتکنندگان بهگونهای باشد که نماینده کاربران واقعی باشند.
- محیط آزمایش تا حد امکان مشابه شرایط واقعی استفاده از دستگاه طراحی شود.
- روش جمعآوری دادهها (برای تحلیل خطاها و مشکلات استفاده) از پیش مشخص شود.
مرحله هشتم: اﻧﺠﺎم ﻃﺮاﺣﻲ رابط ﻛﺎرﺑﺮی، ﭘﻴﺎدهﺳﺎزى و ارزﻳﺎﺑﻲ ﺗﻜﻮﻳﻨﻲ
در این مرحله، طراحی رابط کاربری وسیله پزشکی انجام و پیادهسازی میشود، ارزیابیهای تکوینی بر روی آن را صورت میگیرد و در صورت نیاز اصلاح میشود تا از ایمنی و سهولت استفاده اطمینان حاصل شود. اگر استفاده از دستگاه نیاز به آموزش داشته باشد، آموزش لازم تهیه میشود و در طول عمر دستگاه در دسترس کاربران قرار گرفته میشود.
مرحله نهم: اﻧﺠﺎم ارزﻳﺎﺑﻲ ﻛﻠﻲ از ﻗﺎﺑﻠﻴﺖ اﺳﺘﻔﺎده رابط ﻛﺎرﺑﺮی
پس از ﺗﻜﻤﻴﻞ ﻃﺮاﺣﻲ، ﭘﻴﺎدهﺳﺎزى و ارزیابیهای تکوینی رابط ﻛﺎرﺑﺮی، ﻳﻚ ارزﻳﺎﺑﻲ ﻛﻠﻲ از ﻫـﺮ ﺳـﻨﺎرﻳﻮى استفاده ﻣﺮﺗﺒﻂ ﺑﺎ خطر اﻧﺘﺨﺎبﺷﺪه در مرحله پنجم انجام میشود تا اطمینان حاصل شود کاربران میتوانند با ایمنی کافی از دستگاه استفاده کنند. اهداف ارزیابی کلی شامل موارد زیر است:
- شناسایی تمام خطاهای استفاده و مشکلات کاربری که ممکن است رخ دهند.
- بررسی اینکه آیا خطاهای استفاده میتوانند به وضعیتهای خطرناک منجر شوند.
- تعیین علت ریشهای مشکلات با استفاده از روشهایی مانند مشاهده عملکرد کاربران و دریافت بازخورد مستقیم از آنها.
ارزیابی کلی بر روی رابط کاربری نهایی یا نمونهای که نماینده تولید واقعی است، انجام میشود.
دادههای به دست آمده از این مرحله بررسی و تحلیل میشود و تمام خطاها و مشکلات ثبت میشوند. در صورتی که یک خطای استفاده یا دشواری در استفاده بتواند به یک وضعیت خطرناک منجر شود، علت ریشهای آن تعیین میشود. اگر در این تحلیل، خطاهای جدید یا خطرات ناشناختهای کشف شود: در صورتی که نیاز به اصلاح طراحی و آموزش وجود داشته باشد، مراحل طراحی و پیادهسازی رابط کاربری دوباره اجرا میشوند و اگر اصلاح اضافی لازم نباشد، مستند میشود که چرا توسعه بیشتر ضروری نبوده و بررسی ریسک باقیمانده انجام میشود. دادههای ارزیابی کلی برای تعیین ریسک باقیمانده استفاده میشوند و هرگونه ریسک باقیمانده بر اساس استاندارد ISO 14971 بررسی میشود.
منابع:
1.IEC 62366-1:2020 – Medical devices: Part 1: Application of usability engineering to medical devices
2.IEC 60601-1-6:2020 – General requirements for basic safety and essential performance – Collateral standard: Usability
3.Applying Human Factors and Usability Engineering to Medical Devices: Guidance for Industry and Food and Drug Administration Staff
4.IEC TR 62366-2:2016 – Medical devices – Part 2: Guidance on the application of usability engineering to medical devices


